แอลคีนแอลคีน (alkene) คือ สารประกอบไฮโดรคาร์บอนที่มีพันธะคู่อยู่ในโมเลกุล 1 พันธะ นอกนั้นเป็นพันธะเดี่ยว จัดเป็นสารประกอบไฮโดรคาร์บอนชนิดไม่อิ่มตัว ในทำนองเดียวกับแอลเคน แต่แอลคีนมีจำนวนไฮโดรเจนน้อยกว่าแอลเคนอยู่ 2 ตัว สูตรโมเลกุลทั่วไปของแอลคีนจึงเป็น CnH2n เมื่อ n คือจำนวนคาร์บอน
การเรียกชื่อ ในทำนองเดียวกับแอลเคนแต่เปลี่ยนเสียงท้ายเป็น "……น(-ene)" เช่น
-C2H4 อ่านว่า "อีทีน" (ethene) หรือ "เอทิลีน" (ethylene)
-C3H6 อ่านว่า "โพรพีน" (propene)
การเรียกชื่อแอลคีนแอลคีนสามารถเรียกชื่อได้ทั้ง 2 ระบบในทำนองเดียวกันกับแอลเคน คือชื่อสามัญและชื่อ IUPAC
ก. การเรียกชื่อสามัญของแอลคีน
แอลคีนที่นิยมเรียกชื่อสามัญมีเพียง 2 - 3 ชนิดเท่านั้น
ข. การเรียกชื่อ IUPAC ของแอลคีน
มีหลักทั่วๆ ไปดังนี้
1. เลือกโครงสร้างหลักจากคาร์บอนที่ต่อกันยาวที่สุดและมีพันธะคู่ด้วย
2.เรียกชื่อโครงสร้างหลักตามจำนวน C อะตอมเหมือนกับแอลเคน
3.ถ้ามีพันธะคู่เพียง 1 แห่งในโมเลกุล ให้ลงท้าย -ene ถ้ามีหลายแห่งจะต้องเปลี่ยนคำลงท้าย โดยบอกจำนวนพันธะคู่ที่มีทั้งหมดเป็นภาษาละติน เช่น
· มีพันธะคู่ 2 แห่ง คำลงท้ายเป็น -adiene
· มีพันธะคู่ 3 แห่ง คำลงท้ายเป็น -atriene
4.การนับจำนวนคาร์บอนในโครงสร้างหลักให้นับจากด้านที่จะทำให้ตำแหน่งของพันธะคู่เป็นเลขน้อยที่สุด
5.เนื่องจากแอลคีนมีไอโซเมอร์หลายชนิด ดังนั้นต้องบอกตำแหน่งของพันธะคู่ให้ถูกต้องด้วย โดยบอกตำแหน่งพันธะคู่ด้วยเลขตำแหน่งแรก (ตัวเลขน้อยกว่า) ของพันธะคู่ 6.ถ้ามีหมู่แอลคิลมาเกาะที่โครงสร้างหลัก ให้เรียกชื่อแบบเดียวกับกรณีแอลเคน
สมบัติของแอลคีน1. สมบัติทางกายภาพ1) แอลคีนที่โมเลกุลเล็ก ๆ มีจำนวนอะตอม C 2–4 อะตอมจะมีสถานะเป็นแก๊ส เมื่อขนาดโมเลกุลใหญ่ขึ้น C 5–8 อะตอม เป็นของเหลว ถ้าขนาดใหญ่กว่านี้จะเป็นของแข็ง
2) เป็นโมเลกุลโคเวเลนต์ไม่มีขั้ว จึงไม่ละลายในตัวทำละลายมีขั้ว เช่น น้ำ แต่ละลายได้ดีในตัวทำละลายที่ไม่มีขั้ว เช่น benzene toluene
3) ไม่นำไฟฟ้าในทุกสถานะ มีกลิ่นเฉพาะตัว เช่น C2H4 เมื่อดมมาก ๆ อาจสลบได้
4) มีความหนาแน่นน้อยกว่าน้ำ เมื่อมวลโมเลกุลเพิ่มขึ้น ความหนาแน่นจะเพิ่มขึ้น
5) จุดหลอมเหลว จุดเดือดต่ำ เพราะแรงยึดเหนี่ยวระหว่างโมเลกุลเป็นแรงลอนดอน
สมบัติทางเคมี1. ปฏิกิริยาการเผาไหม้ แอลคีนติดไฟได้ง่าย เป็นปฏิกิริยาคายความร้อนที่บรรยากาศปกติจะเกิดเขม่าหรือมีควัน แต่ถ้าผาในบริเวณที่มีแก๊สออกซิเจนจำนวนมากเกินพอ จะเกิดปฏิกิริยาสมบูรณ์ ไม่มีเขม่า ได้ CO2 และ H2O ตัวอย่างปฏิกิริยา เช่น
C2H4(g) + 3 O2(g) 2 CO2(g) + 2 H2O(g)
C3H8(g) + 5 O2(g) 3 CO2(g) + 4 H2O(g)
2. ปฏิกิริยารวมตัวหรือปฏิกิริยาการเติม (Addition reaction)แอลคีสามารถเกิดปฏิกิริยาการเติมได้ง่ายตรงบริเวณพันธะคู่ ปฏิกิริยานี้มีชื่อเรียกต่าง ๆ กัน บางปฏิกิริยาไม่ต้องใช้ตัวเร่งปฏิกิริยา แต่บางปฏิกิริยาต้องใช้ตัวเร่งปฏิกิริยาจึงจะเกิดปฏิกิริยาได้ดี มีความว่องไวในการเกิดปฏิกิริยามากกว่าแอลเคน
1) ปฏิกิริยาการเติมเฮโลเจน (Addition of Halogen) เป็นปฏิกิริยาการเติมที่ Cl2 หรือ Br2 สามารถรวมตัวโดยตรงกับแอลคีนตรงพันธะคู่โดยไม่ต้องมีตัวเร่งปฏิกิริยา หรือไม่ต้องใช้แสงสว่าง ถ้ารวมกับ Cl2 เรียกว่า Chlorination ถ้ารวมกับ Br2 เรียกว่า Bromination ปฏิกิริยาที่เกิดขึ้นจะไม่มีแก๊สไฮโดรเจนเฮไลด์ (Hydrogen halide : HX) เกิดขึ้น
ปฏิกิริยานี้เป็นปฏิกิริยาที่สำคัญของแอลคีน โดยเฉพาะปฏิกิริยา Bromination เนื่องจากสามารถใช้บอกความแตกต่างระหว่างแอลคีนกับแอลเคนได้ โดยทั่วไปใช้สารละลาย Br2 ใน CCl4 (Br2/CCl4)
แอลเคน จะไม่ทำปฏิกิริยาฟอกจางสีของ Br2/CCl4 ได้ต่อเมื่อไม่มีแสงสว่าง เมื่อเกิดปฏิกิริยาจะได้ฟองแก๊ส HBr ซึ่งแสดงสมบัติเป็นกรดต่อลิตมัส
แอลคีน จะทำปฏิกิริยาฟอกจางสีของของ Br2/CCl4 ทั้งในที่มืดและที่สว่าง โดยไม่มีฟองแก๊สของ HBr เกิดขึ้น
2) ปฏิกิริยาการเติมไฮโดรเจน (Addition of Hydrogen) เป็นปฏิกิริยาการเติม Br2 หรือเรียกว่า hydrogenation แอลคีนจะรวมตัวกับ H2 ได้เป็นแอลเคน โดยมี Pt , Ni หรือ Pd เป็นตัวเร่งปฏิกิริยา
3) Hydroxylation หรือ Glycol formation แอลคีนสามารถฟอกจางสีหรือทำปฏิกิริยากับสารละลาย KMnO4 ในสารละลายกรด ได้ผลิตภัณฑ์เป็นไกลคอล (glycol) และมีตะกอนสีน้ำตาลดำของแมงกานีส (IV) ออกไซด์เกิดขึ้น ไกลคอลเป็นสารประกอบประเภทแอลกอฮอล์ที่มีหมู่ –OH เกาะอยู่กับ C 2 อะตอมติดกัน
ประโยชน์ชองแอลคีน1. อีทีนและโพรพีน (C2H4 และ C3H6) ชื่อสามัญคือเอทิลีนและโพรพิลีน ตามลำดับ ใช้เป็นสารตั้งต้นในการผลิตพอลิเมอร์ประเภทพอลิเอทิลีนและพอลิโพรพิลีน ตามลำดับ
2. แอลคีนบางชนิดใช้เป็นสารปรุงแต่งกลิ่นอาหาร เช่น ลิโมนีน ซึ่งให้กลิ่นมะนาว
3. ใช้แอลคีนเป็นสารตั้งต้นในการในอุตสาหกรรมผลิตเอทานอล พลาสติก และสารซักฟอก
chemistry
วันพุธที่ 24 สิงหาคม พ.ศ. 2554
น้ำมันดิบ
น้ำมันดิบ (Crude oil) คืออะไร?
น้ำมันดิบคือสารประกอบของไฮโดรคาร์บอนกับสารเคมีอื่นๆ จำนวนเล็กน้อย เช่น สารประกอบซัลเฟอร์ ไนโตรเจน และออกซิเจน โดยการที่จะนำสารต่างๆ เหล่านี้ไปใช้ได้ พวกมันจะต้องถูกแยกออกออกจากกันเสียก่อน กระบวนการแยกเรียกว่าการกลั่น (Refining) น้ำมันดิบที่แตกต่างกันในแต่ละที่ของโลก หรือแม้แต่ความลึกที่แตกต่างกันของน้ำมันหลุมเดียวกันเองก็ยังคงบรรจุสารประกอบไฮโดรคาร์บอนและสารประกอบอื่นๆ ที่แตกต่างกัน นั่นคือเหตุผลว่าทำไมพวกมันจึงมีตั้งแต่สารระเหยง่ายสีอ่อนไปจนถึงน้ำมันดำขุ่นหนา (หนามากเสียจนมันยากที่จะปั้มมันขึ้นมาจากพื้นดินเสียด้วยซ้ำ)
ก๊าซธรรมชาติ (Natural gas) คืออะไร?
ก๊าซธรรมชาติคือสารประกอบของไฮโดรคาร์บอนซึ่งเป็นเพียงโมเลกุลเล็กๆ โดยโมเลกุลเหล่านี้สร้างจากอะตอมของคาร์บอนและไฮโดรเจน ตัวอย่างเช่นก๊าซธรรมชาติที่ใช้ในบ้าน(ก๊าซหุงต้ม) โดยส่วนใหญ่คือมีเทน CH4
น้ำมันดิบ (Crude oil) และ ก๊าซธรรมชาติ (Natural gas) เกิดจากอะไร?
นักวิทยาศาสตร์เชื่อกันว่าเมื่อสัตว์และพืชต่างๆ ตาย พวกมันจะถูกชะล้างโดยน้ำฝน และไหลจมลงสู่ก้นทะเลและทะเลสาบต่างๆ ซึ่งพวกมันจะถูกทับถมโดยชั้นของตะกอนต่างๆ (sediment-สิ่งที่ทับถมกันลงมา เช่น ซากพืช ซากสัตว์ หิน ดิน ทราย) [ดูรูป 1.1] และกระบวนการนี้จะเกิดขึ้นก่อนที่ซากเหล่านี้จะสามารถย่อยสลายไปในอากาศ Anaerobic bacteria (แบคทีเรียซึ่งสามารถมีชีวิตอยู่ได้โดยไม่ใช้ออกซิเจน) จะเริ่มกระบวนการย่อยสลายสารพวกนี้ให้กลายเป็นน้ำมันดิบ และก๊าซธรรมชาติ โดยคาดว่ามันจะมีกระบวนการทางเคมีที่เกี่ยวข้องกันระหว่างซากสิ่งมีชีวิต เกลือที่อยู่ในดินโคลนและน้ำที่อยู่รอบๆ ตัวพวกมันเพราะดูเหมือนว่ามันจะมีวิธีการแตกต่างกันในการเกิดเป็นน้ำมัน
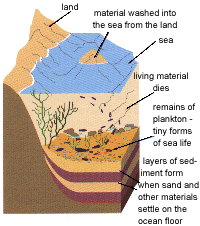 รูป 1.1
รูป 1.1
ในขณะที่ซากของสิ่งมีชีวิตต่างๆ ถูกย่อยสลาย พวกมันก็จะถูกทับถมโดยตะกอนต่างๆ มากขึ้น จากน้ำขึ้นและน้ำลงของทะเล และโคลน ทรายที่แม่น้ำพัดลงมา โดยกระบวนการเหล่านี้จะเกิดขึ้นอย่างช้าๆ เป็นล้านๆ ปีเลยทีเดียว แต่ในที่สุดสารต่างๆ ก็จะถูกเปลี่ยนให้เป็นสารประกอบไฮโดรคาร์บอน[Hydrocarbon] ซึ่งใช้สร้างน้ำมันและก๊าซโดยมีส่วนผสมของทรายและดินเหนียวเข้ามาเจือปน [ดูรูป 1.2] และเมื่อชั้นของสารอินทรีย์ต่างๆ เพิ่มมากขึ้น ค่าความดันและอุณหภูมิซึ่งเป็นปัจจัยของกระบวนการเพิ่มมากขึ้นซึ่งจะส่งผลให้กระบวนการเกิดขึ้นได้เร็ว
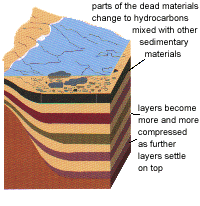 รูป 1.2
รูป 1.2
มีสิ่งหนึ่งที่เราควรจะรู้ นั่นคือสารประกอบไฮโดรคาร์บอนไม่ได้สร้างทะเลน้ำมันไว้ใต้ดินอย่างที่ทุกๆ คนเข้าใจ พวกมันจะถูกผสมเข้ากับน้ำและทรายซึ่งซึมผ่านเข้ามาทางชั้นรูพรุนของหินทราย(Sandstone-หินที่มีส่วนผสมของทรายหรือแร่ควอทซกับดินเหนียว แคลเซียมคาร์บอร์เนต และ ไอออนออกไซด์) หรือ หินปูน (limestone- หินที่ประกอบด้วยสารแคลเซียมคาร์บอร์เนต (CaCO3)) พร้อมกับฟองอากาศของก๊าซ [ดูรูปที่ 1.3] โดยปกติความดันจะช่วยบังคับให้เกิดการผสมกันระหว่างหินพวกนี้ โดยน้ำมันและก๊าซจะถูกกักอยู่ระหว่างช่องว่างของหินตะกอน (sedimenatary rock-หินที่เกิดจากการทับถมกันของตะกอนต่างๆ ในทะเลโบราณ) เหมือนกับน้ำในฟองน้ำ และในที่สุดน้ำมันและก๊าซก็จะพบกับชั้นของหินซึ่งไม่สามารถผ่านไปได้ (หินที่ไม่มีรูพรุน) และพวกมันก็จะถูกกัก(trap) อยู่ในนั้น [ดูรูป 1.4]
 รูป 1.3
รูป 1.3 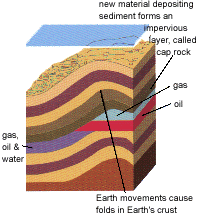 รูป 1.4
รูป 1.4
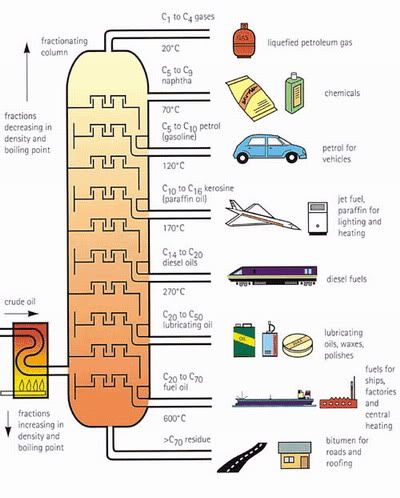
การกลั่นน้ำมัน
Fractional distillation (การกลั่นลำดับส่วน)
น้ำมันดิบคือสารประกอบของไฮโดรคาร์บอนกับส
ก๊าซธรรมชาติ (Natural gas) คืออะไร?
ก๊าซธรรมชาติคือสารประกอบของไฮโดรคาร์บอนซ
น้ำมันดิบ (Crude oil) และ ก๊าซธรรมชาติ (Natural gas) เกิดจากอะไร?
นักวิทยาศาสตร์เชื่อกันว่าเมื่อสัตว์และพื
 รูป 1.1
รูป 1.1ในขณะที่ซากของสิ่งมีชีวิตต่างๆ ถูกย่อยสลาย พวกมันก็จะถูกทับถมโดยตะกอนต่างๆ มากขึ้น จากน้ำขึ้นและน้ำลงของทะเล และโคลน ทรายที่แม่น้ำพัดลงมา โดยกระบวนการเหล่านี้จะเกิดขึ้นอย่างช้าๆ เป็นล้านๆ ปีเลยทีเดียว แต่ในที่สุดสารต่างๆ ก็จะถูกเปลี่ยนให้เป็นสารประกอบไฮโดรคาร์บ
 รูป 1.2
รูป 1.2มีสิ่งหนึ่งที่เราควรจะรู้ นั่นคือสารประกอบไฮโดรคาร์บอนไม่ได้สร้างท
 รูป 1.3
รูป 1.3  รูป 1.4
รูป 1.4การกลั่นน้ำมัน
Fractional distillation (การกลั่นลำดับส่วน)

รูป 1.5 Fractional distillation
น้ำมันดิบคือสารประกอบอันซับซ้อนของไฮโดรคาร์บอนซึ่งสารประกอบต่างๆ จะขึ้นอยู่กับที่มาของแหล่งนั้นๆ สารไฮโดรคาร์บอนในน้ำมันดิบจะมีจุดเดือดที่แตกต่างกันออกไปขึ้นอยู่กับจำนวนคาร์บอนและการจัดตัวในโมเลกุล การกลั่นลำดับส่วนใช้จุดเดือดที่แตกต่างกันในการแยกสารประกอบไฮโดรคาร์บอนในน้ำมันดิบ โดยที่คอลัมน์ด้านบนจะเย็นกว่าทางด้านล่าง ดังนั้นไอต่างๆ จึงเย็นตัวขึ้นเรื่อยๆ เมื่อมันขึ้นสู่ด้านบนโดยไอเหล่านี้จะกลั่นตัวบนถาดเมื่อพวกมันมาถึงส่วนของคอลัมน์ที่เย็นกว่าจุดเดือดของมัน
เมื่อสารต่างๆ ออกมาจากคอลัมน์พวกมันยังต้องผ่านกระบวนการต่างๆ อีกมาก เช่น thermo cracking hydrotreating กว่าจะมาเป็นสิ่งของที่พวกเราใช้กันในวันนี้ได้ เพราะงั้นเราควรใช้สิ่งของต่างๆ อย่างรักษานะคะ ^-^
น้ำมันดิบคือสารประกอบอันซับซ้อนของไฮโดรค
เมื่อสารต่างๆ ออกมาจากคอลัมน์พวกมันยังต้องผ่านกระบวนกา
ปิโตรเลียม
กำเนิดปิโตรเลียม
ปัจจุบันนักธรณีวิทยามีความเชื่อว่า ปิโตรเลียมมีต้นกำเนิดมาจากการตายทับถมกันของซากพืชซากสัตว์ภายใต้พื้นโลกเป็นเวลาล้านๆ ปี จนกลายเป็นชั้นหิน และด้วยอุณหภูมิ และความดันที่สูง ซึ่งเป็นผลมาจากการเคลื่อนตัวของชั้นหินและอุณหภูมิใต้พิภพ อีกทั้งยังต้องมีปริมาณของออกซิเจน (O2) ต่ำเพื่อป้องกันไม่ให้เกิดการสลายตัวของอินทรียสารจากซากสิ่งมีชีวิตเหล่านี้ จากนั้นสารอินทรีย์ซึ่งมีสารประกอบไฮโดรคาร์บอนเป็นส่วนมาก ก็จะเกิดการเปลี่ยนแปลงทางเคมีอย่างช้าๆ จนในท้ายที่สุดจะแปรสภาพเป็นแก๊สธรรมชาติและน้ำมันดิบสะสมและซึมผ่านในชั้นหินที่มีรูพรุน เช่น ชั้นหินทรายและชั้นหินปูน ซึ่งโดยปกติจะปริมาณการสะสมตัวประมาณ 5.25% ของปริมาตรหิน ทั้งนี้ไฮโดรคาร์บอนดังกล่าวสามารถเคลื่อนย้ายไปตามช่องว่างและรอยแตกในหินข้างเคียงได้
ลักษณะโครงสร้างทางธรณีวิทยาของชั้นหินที่เหมาะสมในการกักเก็บปิโตรเลียม คือ
ซามูเอล เอ็ม เกียร์ (Samuel M. Kier) เป็นบุคคลแรกที่ถือได้ว่าขุดพบน้ำมัน โดยในปี พ.ศ. 2391 เขาได้ขุดพบน้ำมันโดยบังเอิญจากบ่อที่เขาขุดขึ้นบนฝั่งแม่น้ำอัลเลเกนี (Allegheny) ในมลรัฐเพ็นน์ซิลวาเนีย (Pennsylvania) และตั้งชื่อน้ำมันดังกล่าวว่า น้ำมันซีนีกา (Seneca oil) ซึ่งเป็นชื่อพื้นเมืองอเมริกัน ต่อมาเมื่อเกิดภาวะขาดแคลนน้ำมันปลาวาฬ ซึ่งขณะนั้นนิยมใช้เป็นเชื้อเพลิงให้แสงสว่าง และใช้เป็นน้ำมันหล่อลื่นสำหรับเครื่องยนต์ต่างๆ กันอย่างแพร่หลาย จึงเป็นแรงผลักดันให้มีการแสวงหาปิโตรเลียมมาใช้ทดแทน และนำไปสู่การจัดตั้งบริษัทเจาะหาน้ำมันชื่อ บริษัทซีนีกาออยส์ จำกัด (Seneca Oil Company) ขึ้นมา
ในช่วงปี พ.ศ. 2402 เป็นช่วงของ ยุคตื่นน้ำมัน ซึ่งเริ่มจากการที่ เอ็ดวิน แอล เดรก (Edwin L. Drake) ถูกส่งไปเจาะสำรวจหาน้ำมันที่เมืองทิทัสวิลล์ (Titusville) ในมลรัฐเพ็นน์ซิลวาเนีย (Pennsylvania) และเขาได้ขุดพบน้ำมันที่ระดับความลึก 69.5 ฟุต โดยมีน้ำมันไหลออกมาด้วยอัตรา 10 บาเรลต่อวัน จึงถือเป็นการเริ่มต้นธุรกิจน้ำมันในเชิงพาณิชย์ของโลกนับตั้งแต่นั้นเป็นต้นมา
สำหรับประเทศไทยนั้นมีหลักฐานปรากฏนับเป็นเวลามากกว่าร้อยปีมาแล้วว่า เจ้าหลวงเชียงใหม่ได้รับรายงานว่ามีการไหลซึมออกมาของปิโตรเลียมที่ฝาง และชาวบ้านในบริเวณนั้นได้ใช้น้ำมันดิบนี้เป็นยาทาแก้โรคผิวหนัง เจ้าหลวงเชียงใหม่จึงได้รับสั่งให้มีการขุดบ่อตื้นขึ้น เพื่อกักเก็บน้ำมันดิบที่ไหลซึมออกมานี้ไว้ และเป็นที่เรียกขานกันในเวลาต่อมาว่า "บ่อหลวง" ต่อมาในปี พ.ศ. 2464 พระเจ้าบรมวงศ์เธอ กรมพระกำแพงเพ็ชรอัครโยธิน เมื่อครั้งทรงดำรงตำแหน่งผู้บัญชาการรถไฟ ได้ทรงริเริ่มนำเข้าเครื่องเจาะมาเพื่อทำการเจาะสำรวจหาน้ำมันดิบ ในบริเวณที่มีผู้พบน้ำมันดิบไหลขึ้นมาบนผิวดินที่บ่อหลวง และยังทรงว่าจ้างนักธรณีวิทยาชาวอเมริกันเข้ามาสำรวจหาน้ำมันดิบ และถ่านหินในประเทศไทยอีกด้วย
1. การขุดเจาะหลุมเพื่อเก็บตัวอย่างหิน (Core Drilling) เป็นวิธีการที่อาศัยการขุดเจาะและเก็บตัวอย่างหินในหลุมเจาะขึ้นมาจากหลุมเจาะหลายๆ หลุมในบริเวณที่ทำการศึกษา และอาศัยการศึกษาตัวอย่างของหินจากหลุมเจาะ รวมทั้งระดับที่แน่นอนของตัวอย่างหิน ก็จะสามารถเปรียบเทียบชนิดของชั้นหิน และโครงสร้างของชั้นหินในบริเวณที่ศึกษาได้
2. การสำรวจโดยคลื่นสั่นสะเทือน (Seismic Prospecting) เป็นวิธีการที่อาศัยความรู้และหลักการของคลื่นไหวสะเทือนโดยอาศัยวัตถุระเบิด สำรวจโดยการขุดเจาะหลุมตื้นประมาณ 50 เมตร เพื่อใช้เป็นจุดระเบิด เมื่อจุดระเบิดขึ้น จะก่อให้เกิดคลื่นไหวสะเทือนวิ่งผ่านลงไปในชั้นหินและเกิดการสะท้อนกลับขึ้นมาสู่ผิวดิน และคำนวณหาความลึกที่คลื่นไหวสะเทือนนี้เดินทางได้ จากนั้นก็จะสามารถทราบโครงสร้างทางธรณีข้างล่างได้
3. การสำรวจโดยความโน้มถ่วง (Gravity Prospecting) เป็นวิธีการที่อาศัยความแตกต่างกันของค่าความถ่วงจำเพาะของหินชนิดต่างๆ ภายใต้เปลือกโลก ถ้าชั้นหินวางตัวอยู่ในแนวระนาบ จะสามารถวัดค่าความโน้มถ่วงที่คงที่ได้ แต่หากชั้นหินการเอียงเท ค่าของความโน้มถ่วงที่วัดได้จะแปรผันไปกับการวางตัวหรือโครงสร้างของชั้นหินนั้น ซึ่งก็จะทำให้ทราบลักษณะการวางตัวและโครงสร้างของชั้นหินนั้นได้จากการแปลผลข้อมูลที่ได้มา
ทั้งนี้ วิธีการทั้ง 3 วิธีการดังกล่าวข้างต้นนี้ ทำให้ทราบได้ว่าโครงสร้างที่พบนั้นมีความเหมาะสมแก่การเป็นแหล่งกักเก็บน้ำมันมากน้อยเพียงใด แต่ไม่ได้บ่งชี้ชัดเจนว่าชั้นหินนั้นจะเป็นชั้นหินกักเก็บน้ำมันหรือไม่
หลังจากที่สำรวจทางธรณีวิทยาและธรณีฟิสิกส์ด้วยการวัดคลื่นความไหวสะเทือน (Seismic Survey) และแปลความหมายเพื่อหาแหล่งกักเก็บปิโตรเลียมอยู่ตรงส่วนใดบ้างใต้พื้นดินและกำหนดจุดเพื่อทำการเจาะสำรวจ คราวนี้ก็เป็นหน้าที่ของเจ้าหน้าที่ฝ่ายขุดเจาะที่ต้องทำการเจาะ "หลุมสำรวจ" (Exploration Well) โดยใช้วิธีเจาะสุ่มซึ่งเราจะเรียกหลุมชนิดนี้ว่า ‘หลุมแรกสำรวจ’ (Wildcat Well) เพื่อสำรวจหาปิโตรเลียมในบริเวณที่ยังไม่เคยมีการเจาะพิสูจน์เลย จากนั้นเมื่อถึงขั้นตอนของการประเมินคุณค่าทางเศรษฐกิจและหาขอบเขตของแหล่งกักเก็บปิโตรเลียม เราจะเจาะหลุมที่เรียกว่า "หลุมประเมินผล" (Delineation Well) และหลังจากที่เราแน่ใจแล้วว่ามีแหล่งกักเก็บปิโตรเลียมในปริมาณที่มากพอในเชิงพาณิชย์ เราจึงเจาะ "หลุมเพื่อการผลิตปิโตรเลียม" (Development Well) เพื่อนำปิโตรเลียมที่สะสมตัวอยู่ใต้พื้นดินขึ้นมาใช้ประโยชน์ต่อไป
การขุดเจาะหลุมเพื่อสำรวจและผลิตปิโตรเลียมนั้นเป็นงานที่ท้าทายและมีความสำคัญอย่างยิ่งเนื่องจากเราต้องขุดไปที่ความลึกประมาณ 3-4 กิโลเมตรใต้พื้นทะเล ในสมัยก่อนการขุดเจาะหลุม 1 หลุมนั้นต้องใช้เวลากว่า 60 วัน โดยใช้งบประมาณกว่า 5 ล้านเหรียญสหรัฐฯ ต่อหลุม [ต้องการอ้างอิง]ซึ่งถือว่าเป็นการลงทุนที่สูงและมีความเสี่ยงมาก เพราะหากเราขุดไปแล้วพบปริมาณน้ำมันหรือแก๊สธรรมชาติที่ไม่คุ้มค่าในเชิงพาณิชย์ การลงทุนนั้นก็สูญเปล่า แต่ในปัจจุบัน ด้วยเทคโนโลยีที่พัฒนาและทันสมัยมากยิ่งขึ้น ระยะเวลาในการขุดเจาะลดลงเหลือเพียง 4-5 วันต่อ 1 หลุม และใช้งบประมาณน้อยลงกว่าเดิม
น้ำมันก๊าด (kerosene) เป็นผลิตภัณฑ์หลักของอุตสาหกรรมปิโตรเลียมในระยะแรก เดิมใช้สำหรับจุดตะเกียงเท่านั้น แต่ปัจจุบัน มีการใช้ประโยชน์อย่างอื่นได้หลายทาง เช่น ใช้เป็นส่วนผสมในยาฆ่าแมลง สีทาบ้าน น้ำมันขัดเงา และน้ำยาทำความสะอาด ใช้เป็นเชื่อเพลิงสำหรับรถแทรกเตอร์ และเป็นเชื้อเพลิงในการเผาเครื่องเคลือบดินเผา
น้ำมันดีเซล (Diesel) ใช้กับเครื่องยนต์ที่มีการทำงานแตกต่างจากเครื่องยนต์เบนซิน เพราะต้องการความร้อนในลูกสูบที่เกิดจากการอัดอากาศสูง มักใช้กับเครื่องกำเนิดไฟฟ้า รถแทรกเตอร์ หัวจักรรถไฟ รถบรรทุก รถโดยสาร และเรือประมง
น้ำมันเตา (fuel oils) เป็นเชื้อเพลิงสำหรับเตาหม้อน้ำ เตาเผา หรือเตาหลอมในโรงงานอุตสาหกรรม ใช้กับเครื่องยนต์เรือเดินสมุทร เครื่องกำเนิดไฟฟ้าขนาดใหญ่
ปัจจุบันนักธรณีวิทยามีความเชื่อว่า ปิโตรเลียมมีต้นกำเนิดมาจากการตายทับถมกันของซากพืชซากสัตว์ภายใต้พื้นโลกเป็นเวลาล้านๆ ปี จนกลายเป็นชั้นหิน และด้วยอุณหภูมิ และความดันที่สูง ซึ่งเป็นผลมาจากการเคลื่อนตัวของชั้นหินและอุณหภูมิใต้พิภพ อีกทั้งยังต้องมีปริมาณของออกซิเจน (O2) ต่ำเพื่อป้องกันไม่ให้เกิดการสลายตัวของอินทรียสารจากซากสิ่งมีชีวิตเหล่านี้ จากนั้นสารอินทรีย์ซึ่งมีสารประกอบไฮโดรคาร์บอนเป็นส่วนมาก ก็จะเกิดการเปลี่ยนแปลงทางเคมีอย่างช้าๆ จนในท้ายที่สุดจะแปรสภาพเป็นแก๊สธรรมชาติและน้ำมันดิบสะสมและซึมผ่านในชั้นหินที่มีรูพรุน เช่น ชั้นหินทรายและชั้นหินปูน ซึ่งโดยปกติจะปริมาณการสะสมตัวประมาณ 5.25% ของปริมาตรหิน ทั้งนี้ไฮโดรคาร์บอนดังกล่าวสามารถเคลื่อนย้ายไปตามช่องว่างและรอยแตกในหินข้างเคียงได้
ลักษณะโครงสร้างทางธรณีวิทยาของชั้นหินที่เหมาะสมในการกักเก็บปิโตรเลียม คือ
- โครงสร้างรูปโค้งประทุนคว่ำ เกิดจากการคดโค้งของชั้นหิน ทำให้มีรูปร่างโค้งคล้ายกระทะคว่ำหรือหลังเต่าน้ำมันและแก๊สธรรมชาติจะเคลื่อนเข้าไปรวมตัวกันอยู่ในส่วนโค้งก้นกระทะด้านบน โดยมีชั้นหินเนื้อแน่นปิดทับอยู่
- โครงสร้างรูปประดับชั้น สามารถเกิดขึ้นได้หลายรูปแบบ ขึ้นอยู่กับการเปลี่ยนแปลงของชั้นหิน โดยที่ชั้นหินกักเก็บปิโตรเลียมจะถูกปิดล้อมเป็นกะเปาะอยู่ระหว่างชั้นหินเนื้อแน่น
- โครงสร้างรูปโดม เกิดจากการดันตัวของโดมเกลือ ผ่านชั้นหินกักเก็บน้ำมัน และจะเกิดการสะสมของปิโตรเลียมอยู่ด้านข้างของชั้นโดมเกลือนั้น
- โครงสร้างรูปรอยเลื่อน เกิดการเลื่อนตัวชั้นหิน ทำให้เกิดรอยแตก (Fault) ขึ้น และทำให้ชั้นหินที่มีเนื้อแน่นเลื่อนมาปิดทับชั้นหินที่มีรูพรุนที่มีปิโตรเลียมอยู่ ปิโตรเลียมจึงสามารถกักเก็บอยู่ในชั้นหินนั้นได้การค้นพบปิโตรเลียม
ซามูเอล เอ็ม เกียร์ (Samuel M. Kier) เป็นบุคคลแรกที่ถือได้ว่าขุดพบน้ำมัน โดยในปี พ.ศ. 2391 เขาได้ขุดพบน้ำมันโดยบังเอิญจากบ่อที่เขาขุดขึ้นบนฝั่งแม่น้ำอัลเลเกนี (Allegheny) ในมลรัฐเพ็นน์ซิลวาเนีย (Pennsylvania) และตั้งชื่อน้ำมันดังกล่าวว่า น้ำมันซีนีกา (Seneca oil) ซึ่งเป็นชื่อพื้นเมืองอเมริกัน ต่อมาเมื่อเกิดภาวะขาดแคลนน้ำมันปลาวาฬ ซึ่งขณะนั้นนิยมใช้เป็นเชื้อเพลิงให้แสงสว่าง และใช้เป็นน้ำมันหล่อลื่นสำหรับเครื่องยนต์ต่างๆ กันอย่างแพร่หลาย จึงเป็นแรงผลักดันให้มีการแสวงหาปิโตรเลียมมาใช้ทดแทน และนำไปสู่การจัดตั้งบริษัทเจาะหาน้ำมันชื่อ บริษัทซีนีกาออยส์ จำกัด (Seneca Oil Company) ขึ้นมา
ในช่วงปี พ.ศ. 2402 เป็นช่วงของ ยุคตื่นน้ำมัน ซึ่งเริ่มจากการที่ เอ็ดวิน แอล เดรก (Edwin L. Drake) ถูกส่งไปเจาะสำรวจหาน้ำมันที่เมืองทิทัสวิลล์ (Titusville) ในมลรัฐเพ็นน์ซิลวาเนีย (Pennsylvania) และเขาได้ขุดพบน้ำมันที่ระดับความลึก 69.5 ฟุต โดยมีน้ำมันไหลออกมาด้วยอัตรา 10 บาเรลต่อวัน จึงถือเป็นการเริ่มต้นธุรกิจน้ำมันในเชิงพาณิชย์ของโลกนับตั้งแต่นั้นเป็นต้นมา
สำหรับประเทศไทยนั้นมีหลักฐานปรากฏนับเป็นเวลามากกว่าร้อยปีมาแล้วว่า เจ้าหลวงเชียงใหม่ได้รับรายงานว่ามีการไหลซึมออกมาของปิโตรเลียมที่ฝาง และชาวบ้านในบริเวณนั้นได้ใช้น้ำมันดิบนี้เป็นยาทาแก้โรคผิวหนัง เจ้าหลวงเชียงใหม่จึงได้รับสั่งให้มีการขุดบ่อตื้นขึ้น เพื่อกักเก็บน้ำมันดิบที่ไหลซึมออกมานี้ไว้ และเป็นที่เรียกขานกันในเวลาต่อมาว่า "บ่อหลวง" ต่อมาในปี พ.ศ. 2464 พระเจ้าบรมวงศ์เธอ กรมพระกำแพงเพ็ชรอัครโยธิน เมื่อครั้งทรงดำรงตำแหน่งผู้บัญชาการรถไฟ ได้ทรงริเริ่มนำเข้าเครื่องเจาะมาเพื่อทำการเจาะสำรวจหาน้ำมันดิบ ในบริเวณที่มีผู้พบน้ำมันดิบไหลขึ้นมาบนผิวดินที่บ่อหลวง และยังทรงว่าจ้างนักธรณีวิทยาชาวอเมริกันเข้ามาสำรวจหาน้ำมันดิบ และถ่านหินในประเทศไทยอีกด้วย
การสำรวจหาแหล่งปิโตรเลียม
การสำรวจหาแหล่งปิโตรเลียม เป็นการหาพื้นที่ซึ่งอาจมีชั้นหินกักเก็บปิโตรเลียมอยู่ โดยสามารถแบ่งขั้นตอนได้เป็นดังนี้ขั้นตอนการสำรวจหาข้อมูล (Exploration)
ในการสำรวจหาแหล่งปิโตรเลียม นักธรณีวิทยาจะใช้วิธีการสำรวจอยู่หลายวิธีด้วยกัน ดังนี้1. การขุดเจาะหลุมเพื่อเก็บตัวอย่างหิน (Core Drilling) เป็นวิธีการที่อาศัยการขุดเจาะและเก็บตัวอย่างหินในหลุมเจาะขึ้นมาจากหลุมเจาะหลายๆ หลุมในบริเวณที่ทำการศึกษา และอาศัยการศึกษาตัวอย่างของหินจากหลุมเจาะ รวมทั้งระดับที่แน่นอนของตัวอย่างหิน ก็จะสามารถเปรียบเทียบชนิดของชั้นหิน และโครงสร้างของชั้นหินในบริเวณที่ศึกษาได้
2. การสำรวจโดยคลื่นสั่นสะเทือน (Seismic Prospecting) เป็นวิธีการที่อาศัยความรู้และหลักการของคลื่นไหวสะเทือนโดยอาศัยวัตถุระเบิด สำรวจโดยการขุดเจาะหลุมตื้นประมาณ 50 เมตร เพื่อใช้เป็นจุดระเบิด เมื่อจุดระเบิดขึ้น จะก่อให้เกิดคลื่นไหวสะเทือนวิ่งผ่านลงไปในชั้นหินและเกิดการสะท้อนกลับขึ้นมาสู่ผิวดิน และคำนวณหาความลึกที่คลื่นไหวสะเทือนนี้เดินทางได้ จากนั้นก็จะสามารถทราบโครงสร้างทางธรณีข้างล่างได้
3. การสำรวจโดยความโน้มถ่วง (Gravity Prospecting) เป็นวิธีการที่อาศัยความแตกต่างกันของค่าความถ่วงจำเพาะของหินชนิดต่างๆ ภายใต้เปลือกโลก ถ้าชั้นหินวางตัวอยู่ในแนวระนาบ จะสามารถวัดค่าความโน้มถ่วงที่คงที่ได้ แต่หากชั้นหินการเอียงเท ค่าของความโน้มถ่วงที่วัดได้จะแปรผันไปกับการวางตัวหรือโครงสร้างของชั้นหินนั้น ซึ่งก็จะทำให้ทราบลักษณะการวางตัวและโครงสร้างของชั้นหินนั้นได้จากการแปลผลข้อมูลที่ได้มา
ทั้งนี้ วิธีการทั้ง 3 วิธีการดังกล่าวข้างต้นนี้ ทำให้ทราบได้ว่าโครงสร้างที่พบนั้นมีความเหมาะสมแก่การเป็นแหล่งกักเก็บน้ำมันมากน้อยเพียงใด แต่ไม่ได้บ่งชี้ชัดเจนว่าชั้นหินนั้นจะเป็นชั้นหินกักเก็บน้ำมันหรือไม่
ขั้นตอนการขุดเจาะ (Drilling)
เป็นการขุดเจาะหลุมเพื่อการผลิต โดยหลังจากที่ทำการสำรวจทางธรณีวิทยา จนทราบว่าน่าจะมีปิโตรเลียมอยู่ในบริเวณใดบ้าง ก็จะต้องทำการเจาะ หลุมสำรวจ (Exploration Well) โดยใช้วิธีสุ่มเจาะ เพื่อสำรวจหาปิโตรเลียมในบริเวณที่ยังไม่เคยมีการเจาะพิสูจน์มาก่อน จากนั้นก็จะมีการประเมินคุณค่าทางเศรษฐกิจและหาขอบเขตของแหล่งกักเก็บนั้น เพื่อให้แน่ใจว่าแหล่งกักเก็บนี้มีปริมาณมากพอในเชิงพาณิชย์ จึงจะทำการเจาะหลุมเจาะเพื่อนำปิโตรเลียมที่สะสมตัวอยู่นั้นขึ้นมาใช้ประโยชน์ต่อไปหลังจากที่สำรวจทางธรณีวิทยาและธรณีฟิสิกส์ด้วยการวัดคลื่นความไหวสะเทือน (Seismic Survey) และแปลความหมายเพื่อหาแหล่งกักเก็บปิโตรเลียมอยู่ตรงส่วนใดบ้างใต้พื้นดินและกำหนดจุดเพื่อทำการเจาะสำรวจ คราวนี้ก็เป็นหน้าที่ของเจ้าหน้าที่ฝ่ายขุดเจาะที่ต้องทำการเจาะ "หลุมสำรวจ" (Exploration Well) โดยใช้วิธีเจาะสุ่มซึ่งเราจะเรียกหลุมชนิดนี้ว่า ‘หลุมแรกสำรวจ’ (Wildcat Well) เพื่อสำรวจหาปิโตรเลียมในบริเวณที่ยังไม่เคยมีการเจาะพิสูจน์เลย จากนั้นเมื่อถึงขั้นตอนของการประเมินคุณค่าทางเศรษฐกิจและหาขอบเขตของแหล่งกักเก็บปิโตรเลียม เราจะเจาะหลุมที่เรียกว่า "หลุมประเมินผล" (Delineation Well) และหลังจากที่เราแน่ใจแล้วว่ามีแหล่งกักเก็บปิโตรเลียมในปริมาณที่มากพอในเชิงพาณิชย์ เราจึงเจาะ "หลุมเพื่อการผลิตปิโตรเลียม" (Development Well) เพื่อนำปิโตรเลียมที่สะสมตัวอยู่ใต้พื้นดินขึ้นมาใช้ประโยชน์ต่อไป
การขุดเจาะหลุมเพื่อสำรวจและผลิตปิโตรเลียมนั้นเป็นงานที่ท้าทายและมีความสำคัญอย่างยิ่งเนื่องจากเราต้องขุดไปที่ความลึกประมาณ 3-4 กิโลเมตรใต้พื้นทะเล ในสมัยก่อนการขุดเจาะหลุม 1 หลุมนั้นต้องใช้เวลากว่า 60 วัน โดยใช้งบประมาณกว่า 5 ล้านเหรียญสหรัฐฯ ต่อหลุม [ต้องการอ้างอิง]ซึ่งถือว่าเป็นการลงทุนที่สูงและมีความเสี่ยงมาก เพราะหากเราขุดไปแล้วพบปริมาณน้ำมันหรือแก๊สธรรมชาติที่ไม่คุ้มค่าในเชิงพาณิชย์ การลงทุนนั้นก็สูญเปล่า แต่ในปัจจุบัน ด้วยเทคโนโลยีที่พัฒนาและทันสมัยมากยิ่งขึ้น ระยะเวลาในการขุดเจาะลดลงเหลือเพียง 4-5 วันต่อ 1 หลุม และใช้งบประมาณน้อยลงกว่าเดิม
ตอนการผลิต (Production)
หลังจากที่มีการขุดเจาะเอาปิโตรเลียมขึ้นมาแล้ว ปิโตรเลียมที่ได้ก็จะผ่านเข้าสู่กระบวนการต่างๆ บนแท่นเพื่อแยกเอา น้ำ แก๊สคาร์บอนไดออกไซด์ และสารปนเปื้อนอื่นๆ ออกจากน้ำมันดิบและแก๊สธรรมชาตินั้น เพื่อนำเอาน้ำมันดิบและแก๊สธรรมชาติไปใช้ในการผลิตขั้นตอนการสละหลุม (Abandonment)
ในกรณีที่ของหลุมที่ไม่ได้ใช้ประโยชน์แล้ว จะมีการอัดซีเมนต์ลงไปตามท่อผลิต เพื่อป้องกันไม่ให้ของไหลที่มีอยู่ในชั้นหินไหลไปสู่ชั้นหินอื่น ซึ่งอาจไปทำลายชั้นหินกักเก็บปิโตรเลียมใกล้เคียง หรือเข้าไปปนเปื้อนกับชั้นน้ำใต้ดินได้การผลิตปิโตรเลียม
เมื่อแยกเอา น้ำ แก๊สคาร์บอนไดออกไซด์ และสารปนเปื้อนอื่นๆ ออกจากน้ำมันดิบและแก๊สธรรมชาติ น้ำมันดิบจะถูกส่งผ่านไปยังสถานีแยกปิโตรเลียมเพื่อแปรสภาพให้เป็นผลิตภัณฑ์สำเร็จรูปชนิดต่างๆ ที่เหมาะสมต่อการใช้ประโยชน์ในรูปแบบต่างๆการแยก (Separation)
โดยส่วนใหญ่จะแยกโดยวิธีการกลั่นลำดับส่วน (Fractional Distillation) โดยอาศัยความแตกต่างของจุดเดือดของสารประกอบไฮโดรคาร์บอนแต่ละชนิดที่รวมอยู่ในน้ำมันดิบ โดยนำน้ำมันมาให้ความร้อนที่อุณหภูมิ 368-385 องศาเซลเซียส แล้วผ่านเข้าไปในหอกลั่น น้ำมันที่ร้อนจะกลายเป็นไอลอยขึ้นไปยอด และควบแน่นเป็นของเหลวตกลงบนถาดรองรับในแต่ละช่วงของผลิตภัณฑ์ที่ต้องการ จากนั้นของไหลในถาดก็จะไหลออกมาตามท่อเพื่อน้ำไปเก็บแยกตามประเภท และนำไปใช้ต่อไปการเปลี่ยนโครงสร้าง (Conversion)
เนื่องจากผลิตภัณฑ์ที่ได้อาจมีคุณภาพที่ไม่ดีพอ จึงต้องใช้วิธีทางเคมีเพื่อเปลี่ยนโครงสร้างของน้ำมัน ให้น้ำมันที่ได้มีคุณภาพที่ดี เหมาะแก่การนำไปใช้ประโยชน์ในรูปแบบต่างๆการปรับคุณภาพ (Treating)
เป็นการกำจัดสิ่งแปลกปลอมออกจากน้ำมันน้ำมันที่ได้มีการเปลี่ยนแปลงโครงสร้างแล้ว ซึ่งสิ่งแปลกปลอมที่สำคัญจะเป็นสารจำพวกกำมะถัน ซึ่งจะใช้วิธีการฟอกด้วยไฮโดรเจน หรือฟอกด้วยโซดาไฟเพื่อเป็นการกำจัดสารนั้นออกการผสม (Blending)
คือการนำผลิตภัณฑ์ที่ได้มาเติมหรือผสมสารที่เหมาะสม เพื่อให้ได้ผลิตภัณฑ์สำเร็จรูปตามที่ต้องการ เช่น การผสมน้ำมันเบนซินเพื่อเพิ่มเลขออกเทน หรือผสมน้ำมันเตาเพื่อให้ได้ความหนืดตามที่ต้องการผลิตภัณฑ์ปิโตรเลียม
เชื้อเพลิงปิโตรเลียม มีหลายรูปแบบ กล่าวคือ- แก๊สธรรมชาติและแก๊สหุงต้ม (LPG) เป็นผลิตภัณฑ์ที่มีจุดเดือดต่ำมาก มีสถานะเป็นก๊าซที่อุณหภูมิห้องดังนั้น ในการเก็บรักษาต้องเพิ่มความดัน หรือลดอุณหภูมิให้ก๊าซเปลี่ยนสภาพเป็นของเหลว เมื่อลุกไหม้จะให้ความร้อนสูง และมีเปลวที่สะอาด ไม่มีสี ประโยชน์ ใช้เป็นแก๊สหุงต้ม เป็นเชื้อเพลิงสำหรับรถยนต์ รวมทั้งเตาเผา เตาอบต่างๆ
- เชื้อเพลิงเหลว แบ่งเป็น
น้ำมันก๊าด (kerosene) เป็นผลิตภัณฑ์หลักของอุตสาหกรรมปิโตรเลียมในระยะแรก เดิมใช้สำหรับจุดตะเกียงเท่านั้น แต่ปัจจุบัน มีการใช้ประโยชน์อย่างอื่นได้หลายทาง เช่น ใช้เป็นส่วนผสมในยาฆ่าแมลง สีทาบ้าน น้ำมันขัดเงา และน้ำยาทำความสะอาด ใช้เป็นเชื่อเพลิงสำหรับรถแทรกเตอร์ และเป็นเชื้อเพลิงในการเผาเครื่องเคลือบดินเผา
น้ำมันดีเซล (Diesel) ใช้กับเครื่องยนต์ที่มีการทำงานแตกต่างจากเครื่องยนต์เบนซิน เพราะต้องการความร้อนในลูกสูบที่เกิดจากการอัดอากาศสูง มักใช้กับเครื่องกำเนิดไฟฟ้า รถแทรกเตอร์ หัวจักรรถไฟ รถบรรทุก รถโดยสาร และเรือประมง
น้ำมันเตา (fuel oils) เป็นเชื้อเพลิงสำหรับเตาหม้อน้ำ เตาเผา หรือเตาหลอมในโรงงานอุตสาหกรรม ใช้กับเครื่องยนต์เรือเดินสมุทร เครื่องกำเนิดไฟฟ้าขนาดใหญ่
เเอลคีน

- แอลคีน (Alkene)
- แอลคีน เรียกอีกชื่อหนึ่งว่า โอเลฟิน (Olefin) เป็นสารประกอบไฮโดรคาร์บอนไม่อิ่มตัวโดยที่ในโมเลกุลมีพันธะระหว่างคาร์บอนกับคาร์บอนเป็นพันธะคู่อย่างน้อย 1 คู่ มีสูตรโมเลกุลทั่วไปเป็น CnH2n สารแอลคีนตัวแรกที่มีคาร์บอนอยู่ในโมเลกุลเล็กที่สุด จะมีคาร์บอนอย่างน้อย2 อะตอม ซึ่งเอทิลีน (C2H4) เป็นสารไฮโดรคาร์บอนที่ใช้มากในอุตสาหกรรมเพื่อสังเคราะห์สารพอลิเมอร์ และเคยใช้เป็นยาสลบในทางการแพทย์อีกด้วย เอทิลีนมีสูตรโครงสร้าง ดังนี้
 การเรียกชื่อสารประกอบแอลคีน จะเป็นไปตามระบบ IUPAC ที่ควรทราบ คือ
การเรียกชื่อสารประกอบแอลคีน จะเป็นไปตามระบบ IUPAC ที่ควรทราบ คือ - 1. คำลงท้ายของสารแอลคีน คือ อีน (-ene)
- C2H4 = Ethene, C3H6 = Propene,
- C4H8 = Butene, C5H10 = Pentene,
- C6H12 = Hexene, C7H14 = Heptene,
- C8H16 = Octene, C9H18 = Nontene,
- C10H22 = Decene
- 2. ใช้โซ่ต่อเนื่องที่ยาวที่สุด ซึ่งมีพันธะคู่รวมอยู่ด้วยเป็นโซ่หลัก
- 3. <![endif]>ต้องระบุตำแหน่งของพันธะคู่โดยให้คาร์บอนตัวแรกของพันธะคู่มีเลขต่ำสุด เช่น
- 4 3 2 1
- CH3-CH3-CH=CH2 1-Butene
- 4 3 2 1
- CH3-CH3=CH-CH3 2-Butene
- 4. ถ้ามีพันธะคู่มากกว่า 1 พันธะ ต้องระบุตำแหน่งพันธะคู่ให้ชัดเจนแล้วใช้ di
- (หมายถึง 2) tri (หมายถึง 3 ) แทนจำนวนพันธะคู่ โดย di, tri จะอยู่หน้าคำว่า “ene” แต่อยู่หลัง
- คำระบุจำนวนคาร์บอน คือ but, pent, hex….
- 4 3 2 1
- CH2=CH-CH=CH2 1,3-Butadiene (มีพันธะคู่ 2 ตำแหน่ง)
- 7 6 5 4 3 2 1
- CH3-CH=CH- CH= CH= CH –CH2 1,3,5-Heptatriene (มีพันธะคู่ 3 ตำแหน่ง)
 คุณสมบัติทางกายภาพและประโยชน์ของสารแอลคีน
คุณสมบัติทางกายภาพและประโยชน์ของสารแอลคีน - แอลคีนมีคุณสมบัติค่อนข้างคล้ายกับสารแอลเคน กล่าวคือ
- 1. แอลคีนที่มีจำนวนอะตอมของคาร์บอนตั้งแต่ 2-4 อะตอม จะมีสถานะเป็นแก๊สจำนวนอะตอมของคาร์บอนตั้งแต่ 5-17 อะตอมจะเป็นของเหลว และถ้ามีจำนวนอะตอมของคาร์บอนตั้งแต่ 18 ขึ้นไป จะเป็นของแข็ง
- 2. แอลคีนเป็นสารประกอบไฮโดรคาร์บอนที่ไม่อิ่มตัว จึงเป็นสารที่ไวต่อปฏิกิริยากว่าแอลแคน
- 3. ภายในโมเลกุลของแอลคีนมีพันธะคู่ตั้งแต่ 1 พันธะ ที่ปะปนอยู่กับพันธะเดี่ยว
- 4. แอลคีนไม่ละลายน้ำ จัดเป็นสารประกอบโคเวเลนต์แบบไม่มีขั้ว จะละลายได้ดีในตัวทำละลายอินทรีย์
- 5. ติดไฟง่าย แต่อาจมีเขม่า
- 6. มีกลิ่นเฉพาะตัว
- 7. มีความหนาแน่นน้อยกว่าน้ำ
- 8. มีจุดเดือดและจุดหลอมเหลวต่ำ แต่จุดเดือดจะสูงขึ้นเมื่อจำนวนคาร์บอนในโมเลกุลเพิ่ม
-
 คุณสมบัติทางเคมีของสารแอลคีน
คุณสมบัติทางเคมีของสารแอลคีน
- 1. ปฏิกิริยาการรวมตัว (Addition) สารแอลคีนมีพันธะคู่ ภายในโมเลกุลจึงทำใหมีความว่องไวในการเกิดปฏิกิริยา และสารที่เข้าทำปฏิกิริยาจะรวมกับแอลคีนที่ตรงตำแหน่งของพันธะคู่ตัวอย่างเช่น แอลคีนทำปฏิกิริยากับกรดกำมะถัน
- 2. <![endif]>ปฏิกิริยาการเผาไหม้กับออกซิเจนในอากาศ (Oxidation Reaction) ได้แก๊สคาร์บอน-ไดออกไซด์กับน้ำ และให้ความร้อนออกมา ดังสมการ
- 3. <![endif]>แอลคีนทำปฏิกิริยากับสารละลายโบรมีน (Br2) ในคาร์บอนเดตระคลอไรด์ (CCl4) ได้ ทั้งในที่มืดและที่มีแสงสว่าง จะได้ผลผลิต ดังสมการ
- แอลคีน (หรือแอลไคน์) ซึ่งเป็นสารประกอบไฮโดรคาร์บอนที่ไม่อิ่มตัวจะนิยมทดสอบด้วย Br2 ใน CCl4 ในห้องปฏิบัติการทางวิทยาศาสตร์ ถ้าสีของ Br2 ถูกฟอกจางในที่มืดได้แสดงว่าสารประกอบที่เรานำมาทดสอบนั้นมีพันธะคู่หรือพันธะสามอยู่
- 4. แอลคีนทำปฏิกิริยากับด่างทับทิม (KMnO4) ในสารละลายกรด นิยมเรียกว่า ปฏิกิริยาออกซิเดชัน (Oxidation reaction) หลังจากทำปฏิกิริยาแล้ว KMnO4 จะถูกฟอกจางสีจึงอาจเรียกปฏิกิริยานี้อีกชื่อหนึ่งว่า ปฏิกิริยาฟอกจางสี
- 5. ปฏิกิริยาพอลิเมอร์ไรเซซัน เป็นปฏิกิริยารวมตัวชนิดหนึ่ง เกิดจากโมเลกุลเล็ก ๆ ของแอลคีน (หรือแอลไคน์) หรือเรียกอีกชื่อว่า มอนอเมอร์ (Monomer) มารวมกันเป็นโมเลกุลที่ยาวมีมวลโมเลกุลสูงขึ้นจนเรียกว่า พอลิเมอร์ (Polymer
สมัครสมาชิก:
บทความ (Atom)